文丨独具药眼
今年2月,默克同意支付3.94亿美元收购一家澳大利亚溶瘤病毒研发公司;5月初,强生旗下公司杨森制药宣布将支付高达10亿美元收购一家生产溶瘤病毒的公司。今年4月,约有300人参加了在英国牛津举行的国际溶瘤病毒会议,而在过去,这一会议参与者不足60人。近期医药巨头们频繁地在溶瘤病毒领域“攻城掠地”,而相关学术会议影响力越来越大。这一系列迹象表明,制药行业和学术界对这一新型抗癌疗法的兴趣正在“升温”。
溶瘤病毒疗法是一种利用病毒特异性地在肿瘤细胞中复制继而杀伤肿瘤细胞,并刺激机体产生特异性抗肿瘤免疫反应的新型肿瘤治疗方法。相比其他肿瘤治疗方法,溶瘤病毒疗法具有复制高效、杀伤效果好和毒副作用小等特点,已经成为肿瘤治疗研究领域的新热点。
归结起来,溶瘤病毒一般通过以下三种机制发挥抗肿瘤作用:肿瘤选择特异性机制;病毒介导的肿瘤杀伤机制;抗肿瘤免疫反应机制。
其杀死肿瘤细胞的过程如图1所示:
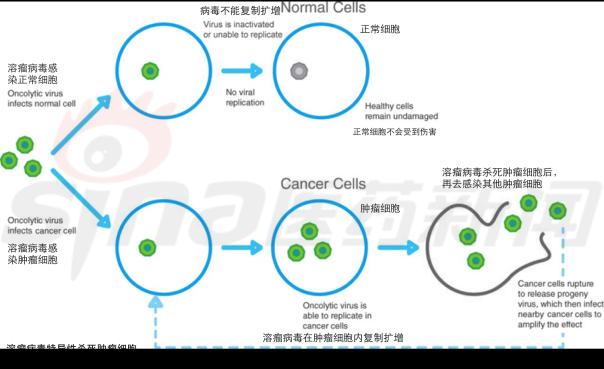
图1 溶瘤病毒特异性杀死肿瘤细胞
发 展 历 程
病毒能够杀死癌细胞已经被发现了快一个世纪,但将此运用于临床试验使得癌症病人获益还是近十年来的事情,这也是基于人们对病毒生物学、肿瘤免疫学以及分子遗传学理解的不断加深。目前,随着基因工程技术的发展,溶瘤病毒已经发展到第三代溶瘤病毒,溶瘤病毒对肿瘤细胞杀伤效率高、靶向性好、安全性高、副作用小和成本低廉,使得其成为未来最具有潜力和应用前景的恶性肿瘤治疗手段之一。溶瘤病毒发展历程如表1所示。
表1 溶瘤病毒历史发展历程

在发现病毒可能对肿瘤有抑制作用之后,人们开始利用变异后的野生型病毒或天然弱毒病毒株对癌细胞进行治疗研究。然而,无论使用野生型病毒还是减毒毒株,都存在很大的风险。比如,有些病毒本身就具有致癌的风险;有些病毒会导致具有遗传特质的个体出现严重的急性反应;有些减毒病毒也存在通过突变回复毒力的可能性。而更让科学家头疼的是,给病人接种病毒会激活宿主的免疫反应,还没等病毒把肿瘤细胞杀死,病毒自己就先被清除掉了。正因如此,要想使用病毒来治疗人类疾病,必须对病毒进行适当改造。
对于溶瘤病毒的改造过程非常复杂,需要进行大量的实验验证,不过总体上的思路都是一致的,那就是专化,强化和弱化。
科学家选择利用病毒来治疗恶性肿瘤,首先看中的是病毒感染细胞的特异性。科学家们通过改造溶瘤病毒表面的蛋白质,使得它只能够认识肿瘤细胞表面特异的受体,这样就可以最大程度的降低误伤正常细胞的概率。溶瘤病毒的关键在于“溶瘤”,然而,并不是所有的病毒在感染后都会导致宿主细胞死亡。为了达到目的,科学家们往往选择能够特异的在肿瘤细胞中大量复制并导致肿瘤细胞死亡的病毒进行研究。为了防止被宿主强大的免疫系统清除掉,科学家们还会通过采取一定的方法改变溶瘤病毒的“容貌”来帮助它们逃过免疫系统的识别,这样做的目的是让溶瘤病毒能够发挥更加持久的抗肿瘤作用。
获 批 药 物
2005年11月,一个由腺病毒改造而来的溶瘤病毒H101经过CFDA审批,开始投入临床用于治疗难治性晚期鼻咽癌,这也是世界上第一个由官方批准的溶瘤病毒药物。
2015年10月29日,安进生产的皮肤癌治疗产品Imlygic获得美国FDA的批准,这也是第一款获得FDA批准的溶瘤病毒治疗产品。该药物可用于治疗病灶在皮肤和淋巴结,未能通过手术完全清除的黑色素瘤。Imlygic是经过基因改造的单纯疱疹病毒1(herpes simplex virus-1)。
研究表明,16.3%的接受Imlygic治疗的患者肿瘤体积在6个月内会持续缩小,而对照组只有2.1%。目前没有足够的证据表明Imlygic能够提升黑色素瘤患者的整体存活率,也没有证据表明Imlygic对转移到脑、骨、肝、肺,或其他内部器官的黑色素瘤有疗效。虽然Imlygic的效用并不十分明显,但Imlygic的获批仍具有积极意义。因为Imlygic与其他药物联合使用将显著提高治疗效果。而这种整合方式也是未来对抗癌症的发展方向。
研 发 管 线
目前有多个病毒科的病毒都用于构建溶瘤病毒株,已经进入临床试验的DNA病毒主要有:腺病毒科(腺病毒)、疱疹病毒科 (单纯疱疹病毒)、痘病毒科 (痘苗病毒)、微小病毒科(细小病毒);RNA病毒主要有:小RNA病毒科、副粘病毒科(麻疹病毒)、呼肠孤病毒科、逆转录病毒科、弹状病毒科。并不断有新的新溶瘤病毒进入临床实验。目前,大量的溶瘤病毒的研发处于临床试验阶段,其中大部分处于早期临床阶段。较为关键的溶瘤病毒研发状况如表2所示。
表2 部分进入临床试验的溶瘤病毒项目


联 合 用 药
研究表明,免疫检验点阻断剂仅对部分的实体瘤患者具有较好的疗效,而对大部分实体瘤患者效果不明显,归结其原因是这类药物完全依赖于肿瘤患者瘤内浸润性T淋巴细胞的数量。由于溶瘤病毒对肿瘤细胞的感染能够诱导大量的免疫细胞浸润肿瘤,从而使得免疫检验点阻断剂能够发挥其应有的功能。因此,从治疗原理上来看,溶瘤病毒和免疫检验点阻断剂联合具有很好的互补性,溶瘤病毒能够用其诱导的抗肿瘤免疫特性来弥补免疫检验点阻断剂依赖于T细胞浸润的缺陷。
为达到最佳治疗效果,以溶瘤病毒单药治疗或溶瘤病毒结合传统的化疗、放疗和手术治疗的多个临床实验正在进行。尤其是当溶瘤病毒与PD-1抑制剂等免疫治疗联合使用的时候,小规模数据提示疗效显著。
2017年,顶尖学术杂志《cell》曾报道过一项入组21名志愿者的I期临床试验结果:21名晚期不可切除的恶性黑色素瘤患者,接受PD-1抗体联合T-VEC治疗。结果显示:有效率62%,完全缓解率33%,疾病控制率76%。这样一个疗效数据,堪比PD-1抗体联合CTLA-4抗体,或者PD-1抗体联合IDO抑制剂。
此外,2017年底《JCO》杂志曾报道过另外一项198人参与的二期临床试验结果。198名晚期恶性黑色瘤患者1:1分组,一组接受T-VEC联合伊匹木治疗(98人)、一组接受单独的伊匹木治疗(100人)。两组的有效率,差异明显:39% vs 18%。溶瘤病毒的加盟,让CTLA-4抗体的有效率翻了一倍。
药 企 动 态
2016年10月,勃林格殷格翰与Vira Therapeutics签订协议,将共同开发新一代溶瘤细胞病毒疗法平台,联合研究候选药物水疱性口炎病毒(VSV)糖蛋白(GP)(VSV-GP)及其与其他疗法相结合的可能性。与目前正在研发的其他溶瘤细胞病毒药物相比,VSV-GP的复制时间更短。这种溶瘤细胞病毒不会集成到DNA中,并且经过修改后可以避免野生型病毒引起的神经系统炎症。在VSV-GP中,VSV的糖蛋白被淋巴细胞性脉络丛脑膜炎病毒(LCMV)的糖蛋白替代后,可以在免疫系统藏匿该病毒。
艾伯维宣布与Turnstone Biologics公司达成全球性研发合作协议。Turnstone 是一家专注于新一代溶瘤病毒疗法(oncolytic viral therapy)的临床开发公司。Turnstone公司开发的溶瘤病毒疗法是基于基因工程改造过的马拉巴病毒(Maraba Virus)。该公司的研究人员用基因工程对这种从巴西沙蝇中发现的单链RNA病毒进行了改造。马拉巴病毒的特性让它们可以以较高剂量安全地静脉注射到患者体内,从而可以靶向分布在身体各个部位的转移病灶。
2016年11月30日,恒瑞医药与日本Oncolys BioPharma公司达成协议,有偿获得Oncolys研发的溶瘤腺病毒产品TelomelysinTM(OBP-301)在中国大陆、香港和澳门特别行政区的开发、生产及商业化的独家许可权。
Telomelysin临床I期数据初步显示安全性和有效性。Telomelysin是基因工程改造后的腺病毒,通过引入人类端粒酶反转录酶启动子进行基因修饰,从而可以选择性在肿瘤细胞中进行复制的溶瘤腺病毒。目前,Telomelysin已经在美国完成针对多种实体瘤(n=16)的I期安全性试验。结果显示,28天疾病控制率达到68%。其中一名黑色素瘤患者28天肿瘤体积缩小33%,56天缩小56.75%。
CVA21是一款基于柯萨奇病毒(一种导致普通感冒的病毒)的溶瘤病毒,目前小规模数据提示,该病毒对恶性黑色素瘤、肺癌、前列腺癌、膀胱癌等多种肿瘤都有一定的疗效。相比于T-VEC,CVA21有其自己的优势:这个病毒不仅可以瘤内注射,还可以直接静脉输液,大大简化了操作的复杂性;未经过基因改造,安全线更高。在已经公布结果的Ib期临床试验中, CVA21联合PD-1抗体治疗晚期恶性黑色瘤,23名志愿者入组:有效率为61%,疾病控制率为78%,其中6位患者疗效已经维持超过1年。CVA21单独使用,治疗肺癌和膀胱癌的小规模数据提示,有效率分别为30%(3/10)和28% (5/18),安全性良好(3-4级不良反应的发生率仅为11%)。
值得一提的是,中山大学颜光美团队“溶瘤病毒M1”项目不断取得新突破,成为该领域国内关注的焦点。研究显示,M1病毒具有良好的安全性;M1病毒与靶向内质网相关降解通路(ERAD)的抗癌药物具有协同作用;该团队已找到M1病毒靶向杀伤癌细胞的特征物——锌指抗病毒蛋白(ZAP);目前,团队研发药物的工艺技术难题已经解决,M1病毒经过发酵、纯化的步骤后,最后将制成冻干粉;预计2018年可以进行M1病毒的临床实验。
结 语
作为一种新兴抗肿瘤治疗药物,溶瘤病毒仍然存在很多显而易见的问题,还无法在短时间内完全取代传统的放化疗法。然而,对肿瘤细胞杀伤效率高,靶向性好,安全性高,副作用小和成本低廉将会使得溶瘤病毒成为未来最具有潜力和应用前景的恶性肿瘤治疗手段之一。
尽管溶瘤病毒在肿瘤治疗上取得一定疗效,具有非常广泛的应用前景,但是单一的治疗手段疗效有限。因此,将溶瘤病毒与其他治疗手段联合,尤其是与免疫检查点抑制剂联合是该领域未来的发展方向之一。
