说到人工设计蛋白,华盛顿大学的大卫·贝克(David Baker)教授是业内当之无愧的“大神”。在计算模拟蛋白质功能,并进行人工设计上,这位50多岁的美国科学院院士率领的团队代表了领域的前沿。今年早些时候,他的团队就曾首次从头设计一款抗癌蛋白,其结果也登上了《自然》杂志。
上周,在顶尖学术期刊《科学》上,贝克教授团队再次带来了新的突破。这一次,他们设计的蛋白质会变形!
蛋白为啥要“变形”?
这项研究为啥能发表在《科学》上呢?这就要从它的意义说起。在计算机的辅助下,我们已经得到了一系列蛋白设计的原则,并能从头设计出具有最低自由能的氨基酸序列,让其形成的三维蛋白质结构具有超高的稳定性。
这固然是人工设计蛋白的一大突破,但在实用性上却有着明显受限。这些人造蛋白太稳定了,就像是“岩石”一样硬邦邦。它们可以成为很好的结构框架,或是能与其他蛋白进行紧密结合,但在自然界中,许多天然蛋白更为灵活,能够在不同的环境下展现出不同的构象。这些蛋白也往往具有“开关”的功能,利用不同构象,来做不同的事。
举个例子,流感病毒被内吞进细胞后,表面的血凝素(HA)蛋白会在酸性环境下“变形”,促使胞内体(endosome)的细胞膜与流感病毒的脂质膜进行融合,从而让流感病毒的遗传物质顺利进入细胞质,开始复制。
可以看到,“变形”能给蛋白质附加上许多额外的功能,也是科学家们想要理解和驾驭的蛋白质特性之一。但说起来容易,做起来难。自然界经过数十亿年演化而来的蛋白分子,其氨基酸序列不但能够形成理想的结构,还会根据周围环境做出改变。想要破解自然的密码,谈何容易?
尽显人类智慧
但贝克教授的团队做到了
长年以来,这支团队积累的大量经验让他们把注意力集中到了一种叫做组氨酸的氨基酸上。在中性条件下,这种氨基酸不带有电荷。但当环境变为微酸性时,它就会带上正电荷,从而影响其形成氢键的能力。研究人员们推断,这个性质能帮助蛋白质“变形”。
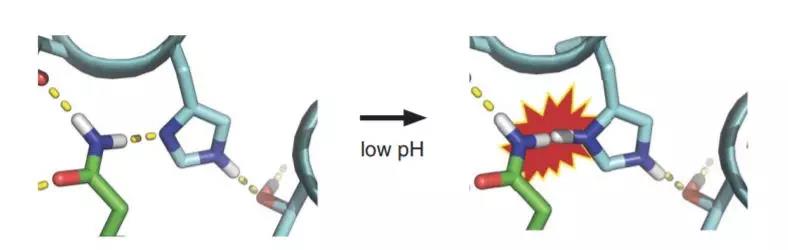
▲组氨酸是蛋白“变形”的关键(图片来源:参考资料[1])
后续的研究也证实了这一设想的可靠。研究人员们利用计算机模拟,设计了一种合成蛋白。经过优化和纯化后,它能在中性条件下进行自我组装,成为多聚体。
接下来,便是见证神奇的时刻了。在酸性条件下,这些蛋白质的组氨酸快速带上了正电荷,从而破坏其蛋白内部的氢键网络,让组装好的多聚体开始解体。这种操作会让蛋白露出疏水残基,使其成为一个两性分子。这不但能促进蛋白单体与脂质膜结合,还能借此影响和破坏膜的结构,让膜出现融合。
使用冷冻电镜技术,研究人员们确认,在酸性条件下,这些蛋白果然可以与脂质体相结合。而在碱性环境里,这种结合能力就消失了。此外,研究人员们还确认,这种结合必须依赖组氨酸的存在。如果将组氨酸替换成其他氨基酸,即便在酸性条件下,这些蛋白也无法结合脂质体。

▲酸性条件下,人工设计的蛋白可以结合并破坏脂质体的膜结构(图片来源:参考资料[1])
这些结果表明,通过人类的设计,蛋白的确在酸性条件下发生了“变形”,并且展露出理想的特质,使膜出现融合。
变革药物递送?
在哺乳动物细胞实验中,这种人造蛋白的“变形”能力再次得到了验证。首先,研究人员们在这种可变形蛋白上做了改造,让它们可以发出绿色荧光。然后,他们在细胞培养液中加入这些蛋白。
后续研究发现,细胞会把它们“一口吞下”。就像人依赖酸性的胃液消化食物,细胞也会把内吞物送到“溶酶体”里进行消化。有趣的是,这些蛋白与溶酶体的位置有着高度重合,说明它们已经进入到了溶酶体内部。但这些蛋白却依旧可以发出荧光,说明它们又没有被消化掉。

▲进入溶酶体但不被降解,彰显了这些蛋白“变形”带来的效果(图片来源:参考资料[1])
这些结果清楚地说明了蛋白的成功“变形”。研究人员解读说,在被细胞吞进去后,这些蛋白在酸性的溶酶体中开始变形,并借此破坏了溶酶体的膜结构。这就好像胃破了一个洞,让胃酸都流了出去一样,自然就削弱了溶酶体的消化能力。
同样,如果把这些可变形蛋白里的组氨酸变成其他氨基酸,这些蛋白也就失去了变形能力。在溶酶体中,它们被消化得干干净净。
在论文的最后,研究人员们指出,目前如果想要将生物制剂递送到细胞质中,需要使用许多比较“粗暴”的方法,因此可能带来毒副作用。病毒载体虽然显得不那么“粗暴”,却也会引起免疫上的风险。本研究中随pH值发生变形的蛋白,具有将胞内体中的分子释放到细胞质内的潜力,因此有望带来一种新颖的药物递送方法。
“设计能够以可预测的方式进行变化的蛋白质,有望带来分子药物的新浪潮,”贝克教授说道:“这些分子能够穿透胞内体,因此有潜力带来药物递送的新工具。”
参考资料:
[1] Scott E. Boyken et al., (2019), De novo design of tunable, pH-driven conformational changes, Science, DOI: 10.1126/science.aav7897
[2] Designing biological movement on the nanometer scale, Retrieved May 16, 2019, from https://newsroom.uw.edu/news/designing-biological-movement-nanometer-scale
