作者 |小米
曾经在中国市场风光无限的科技巨头,现在正处于转型期。
日前,三生制药宣布与三星Bioepis达成一项合作协议,将在中国境内进行三星Bioepis多个生物类似药在研产品的临床研发和商业化,其中包括贝伐珠单抗的生物类似药在研产品SB8。
三星Bioepis?你没有看错,就是那个曾经拥有亿万用户的韩国手机品牌,而现在已被华为、小米等众多中国品牌甩在身后的科技巨头,在IT行业早已成为昨日黄花。
事实上,韩国三星集团旗下拥有电子、金融、机械、化学等众多领域,而此次与三生制药的合作,也被业内视为继默沙东、百健之后,三星Bioepis在生物医疗领域的又一次重要布局。
根据协议,三星Bioepis将负责产品的生产和供应,并与三生制药开展一系列合作包括在中国的临床开发、注册和商业化。三星Bioepis将从三生制药获得预付款和产品供应收入,并将有资格获得相关临床和监管的里程碑付款。双方目前并未透露财务条款。
随着重磅生物药专利陆续到期,生物类似药作为最具市场潜力的“赛道”吸引了不少企业的关注。业内普遍认为,未来2-3年,生物类似药将进入发展的黄金期。据IMS Health预测,至2020年,生物类似药的年销售额有望达到250亿美元,这类药物的黄金时代要来了!
强强联合
瞄准生物类似药市场
韩国三星集团早在2012年就成立三星Biologics,开始布局生物医药领域。随后与美国生物技术公司百健公司合作,致力于生物类似药的研发。2015年11月,三星更是宣布投资8500亿韩元计划建设全球最大规模的生物药品制造工厂。该厂建成后,三星Biologics有望成为全球最大的生物制药合同生产(CMO)企业。
按照韩国三星集团的规划,三星Biologics以CMO为切口进入生物制药领域,三星Bioepis则主攻生物类似药。在短短的几年时间里,三星Bioepis已研发了七个生物类似药产品,包括依那西普、英夫利昔单抗、阿达木单抗、曲妥珠单抗。
截至目前,三星Bioepis已有四款生物类似药在欧洲获批。同时,英夫利昔单抗也已在美国获批,而SB5(阿达木单抗)和SB3(曲妥珠单抗)正在审批之中。
此次三星Bioepis与三生制药合作,主要是将三星Bioepis成熟的开发平台与三生制药强大的商业化平台相结合,快速将生物类似药业务拓展到中国市场。
从三生制药的角度来看,作为一家已经有着20多年发展经验的老牌药企,公司现已成为一家集研发、生产与销售为一体的中国生物制药领军企业,可以说是久经时间的考验,其业绩表现也一直不俗。
以去年8月下旬公布的半年报数据来看,公司营收已经接近22亿,同比增长27.4%,毛利达到17亿,同比增长19.9%,归母净利润5.14亿,同比增长30.9%。
不可否认的是,在我国医药产业之中,发展已相对成熟的企业,在渠道上往往更具有先发优势,一旦产品研发成功,其在运营上和渠道上的经验,能够迅速为其打开市场,进而助力产品销售,为企业业绩带来新的突破。
截止18年中期的数据,三生制药在国内拥有约2727名营销人员,345名分销商及1561名第三方推广商,覆盖超过2000家三级医院及11000家二级及以下层级医院及医疗机构。目前,公司在渠道铺成和销售人员队伍的管理建设上都已经有了一定的基础,而这也将会为后期公司新产品入市抢占市场提供坚实的保障。
此番,三星Bioepis与三生制药两大巨头强强联合,势必将形成更具强大的市场竞争力,有望在未来的生物类似药领域中抢占先机。
三星Bioepis董事长兼首席执行官 Christopher Hansung Ko接受媒体采访时表示,非常高兴能将我们的生物类似药业务拓展到中国,也很期待我们的生物类似药产品在为广大患者提供高质量的医疗服务中起到重要作用。我们有信心通过与三生制药的合作,将三星Bioepis成熟的开发平台和三生制药强大的商业化平台相结合,从而达成我们的目标。
弯道超车
三星Bioepis有望提前获批
近年来,伴随着专利悬崖的到来,众多生物医药公司的畅销药相继失去专利保护。生物类似药市场由此成为医药界的热点,各大药企纷纷追逐这一块大蛋糕,并带动了国内外医药市场生物类似药研制热潮。

以英夫利昔单抗为例,自2013年其类似药在欧洲上市以来该药,2015-2017年原研药在欧洲市场的销售额急速下滑。至2017年英夫利昔单抗的类似药销售额达 4.19 亿美元,同比增长118%,2015-2016年在欧洲的市场份额0.2%增长至33%。
而韩国三星这样的科技巨头似乎看到了其中的商业机会,提前布局生物类似药市场。
此次三星Bioepis与三生制药合作的贝伐珠单抗,是一种重组人源化单克隆抗体,作为世界上第一个抗肿瘤血管生成药物,自2004年首次在美国获得批准上市以来,其被陆续用于结直肠癌、非小细胞肺癌、乳腺癌、恶性胶质瘤和肾细胞癌、卵巢癌等多种肿瘤的一线治疗,其疗效及安全性也已得到多项临床试验的证实。
而就在贝伐珠单抗的专利即将到期之际,不仅仅是三星Bioepis,国内各家药企也都摩拳擦掌,跃跃欲试。2018年8月15日,齐鲁制药提交的贝伐珠单抗类似药上市申请获得承办受理,成为了该领域进度第一。信达生物、东曜药业等8家国产企业皆正在进行三期临床试验,为该品种开发的第一梯队,其余企业大都处于临床早期开发。
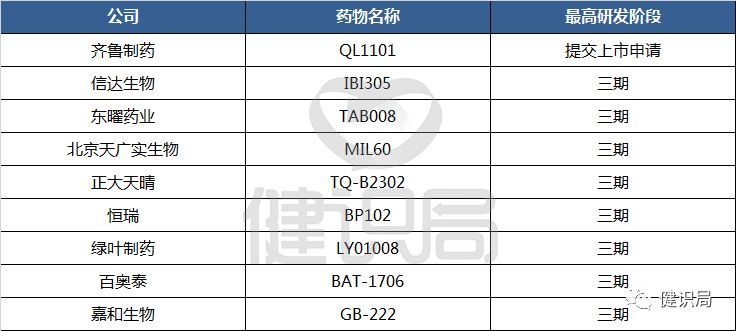
据健识局了解,三星Bioepis的贝伐珠单抗已在欧美等地进行了临床实验,一旦获得中国药监部门的认可,也有可能进入率先上市的梯队。
2018年7月,国家药监总局发布发布《接受药品境外临床试验数据的技术指导原则》(下称《原则》)明确,承认境外临床数据,这意味着新药在中国注册可省下在国内做临床试验的时间,这也将大大缩短境外新药在华上市的周期。
《原则》指出,所涉及的境外临床试验数据,包括但不限于申请人通过药品的境内外同步研发在境外获得的创新药临床试验数据。在境外开展仿制药研发,具备完整可评价的生物等效性数据的,也可用于在中国的药品注册申报。
事实上,与传统化学药物不同,生物类似药来源于活体细胞,无法百分百复制原药产品,因此在证明生物类似药疗效和安全性等方面的技术门槛要比化学药物高得多。
有分析人士指出,目前国内外生物类似药监管环境日益规范,相关指导原则也在不断完善,三星Bioepis可凭借着我国新药审批的政策红利,利用其在欧美发达国家的临床试验数据,有望进入率先获批的第一梯队,实现弯道超车。
虽然目前生物类似药无论是发展前景还是利润空间都超过传统的化药,但各国药品审批与监管部门还是以更审慎的态度对待生物类似药,审批难度更大,不过一旦通过获利也更高。
据中商产业研究院发布的《2018-2023年中国医药生物行业市场前景及投资机会研究报告》数据显示,中国生物医药市场从2013年占中国整体医药市场的8.7%增至2017年的15.3%。
